TRANSFORMS
Disegno dello studio
Studio di fase 3, in doppio cieco, randomizzato, a doppia simulazione, confronto verso controllo attivo, della durata di un anno in adulti affetti da SMRR
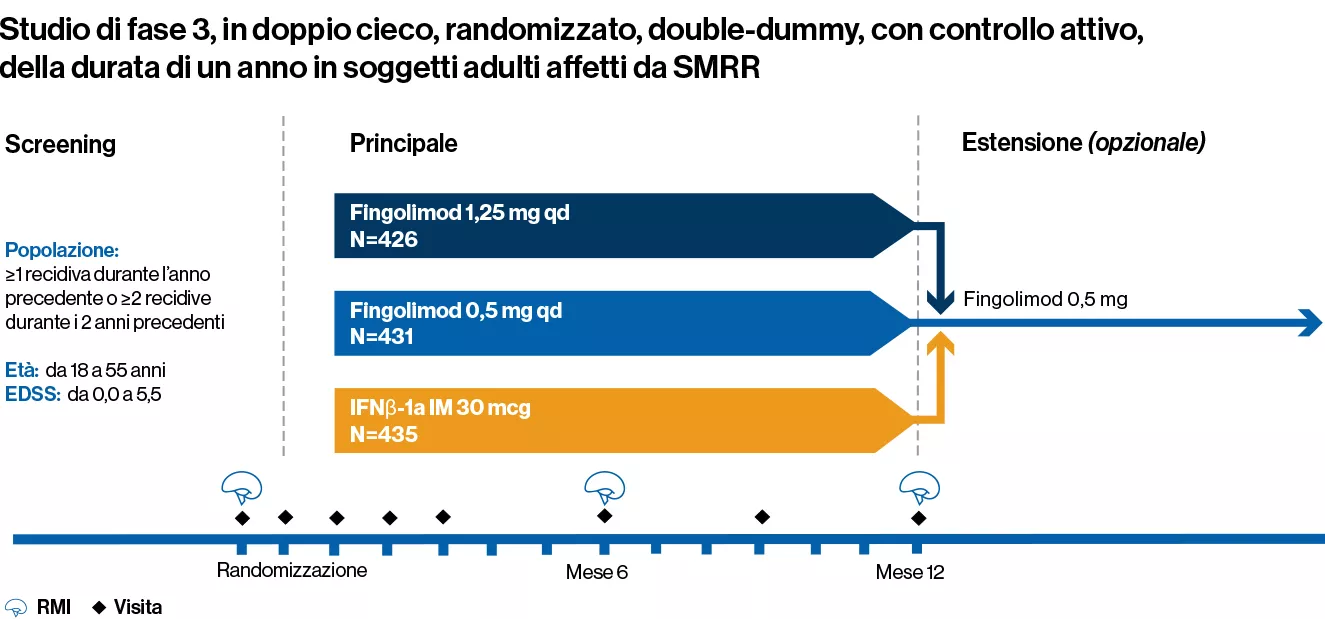
Studio di fase 3 della durata di 1 anno, randomizzato, in doppio cieco, double-dummy, di confronto verso controllo attivo (IFNβ-1a IM) su 1.292 adulti affetti da SMRR
I pazienti sono stati assegnati casualmente a ricevere una dose una volta al giorno di fingolimod 0,5 mg (n=431) o 1,25 mg (n=426) o iniezione IM di IFNβ-1a a una dose settimanale di 30 μg (n=435) per 1 anno
Caratteristiche al basale dei pazienti:
1. Età compresa tra 18 e 55 anni
2. Una diagnosi di SMRR con almeno 1 recidiva documentata durante l’anno precedente o almeno 2 recidive documentate durante i 2 anni precedenti
3. Un punteggio compreso tra 0,0 e 5,5 sulla scala EDSS. Il punteggio mediano al basale era 2,0
4. La precedente terapia con qualsiasi tipo di interferone-beta o glatiramer acetato non era un criterio di esclusione
Endpoint primario: l’obiettivo primario era dimostrare che fingolimod 0,5 mg era superiore a IFNβ-1a in termini di ARR in pazienti con SMRR trattati per un massimo di 12 mesi
Due endpoint secondari principali: numero di lesioni iperintense nuove o di recente aumento di volume alle scansioni di RMI pesata in T2 a 1 anno e tempo alla progressione della disabilità confermata a 3 mesi misurata da un aumento di almeno 1 punto rispetto al basale nella EDSS (aumento di 0,5 punti per i pazienti con EDSS al basale di 5,5) sostenuta per 3 mesi
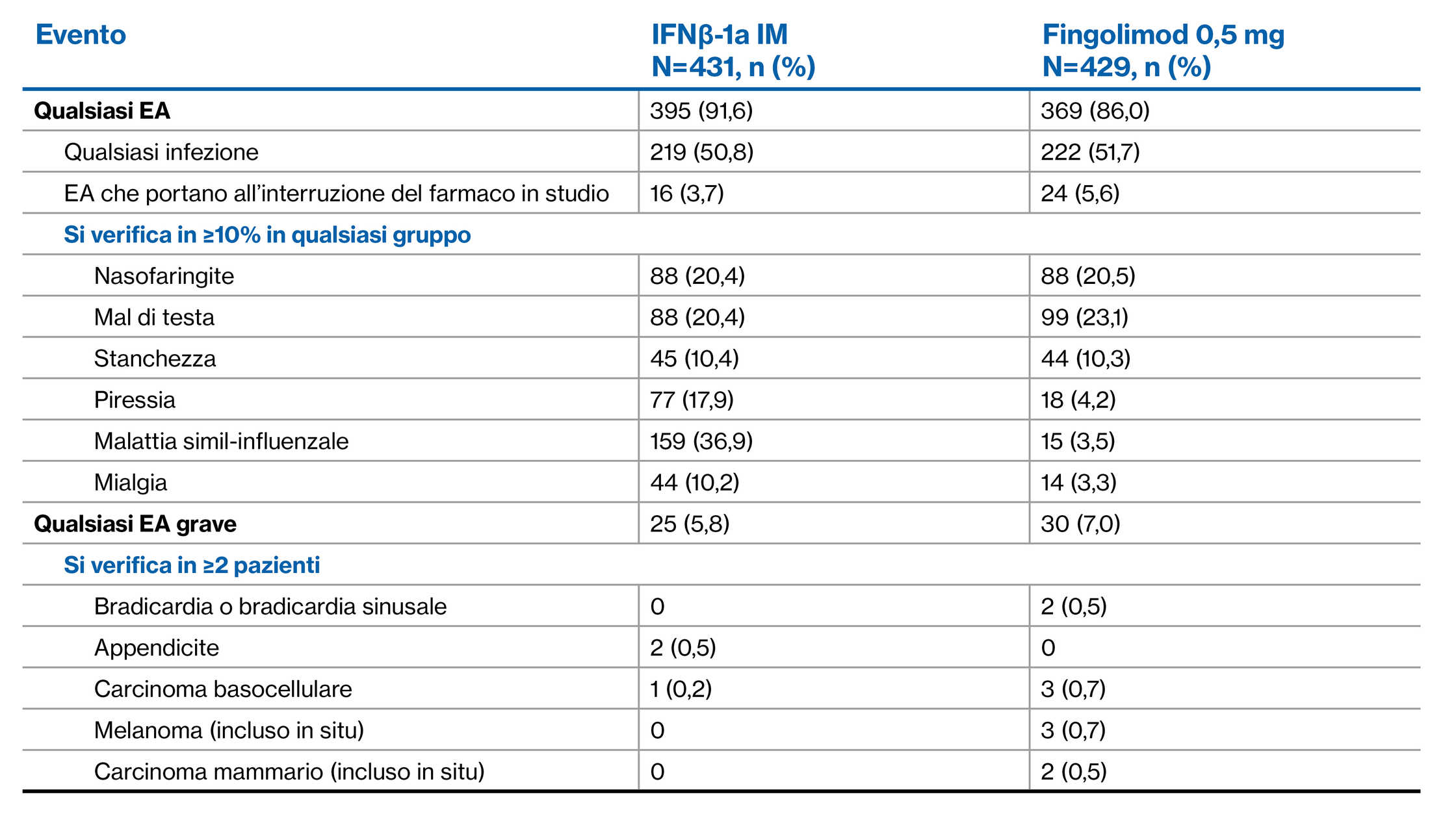
Profilo di EA di fingolimod rispetto a interferone nell’arco di 1 anno: Studio principale TRANSFORMS1
Profilo di EA di fingolimod nell’arco di 4,5 anni: Studio di estensione TRANSFORMS2**
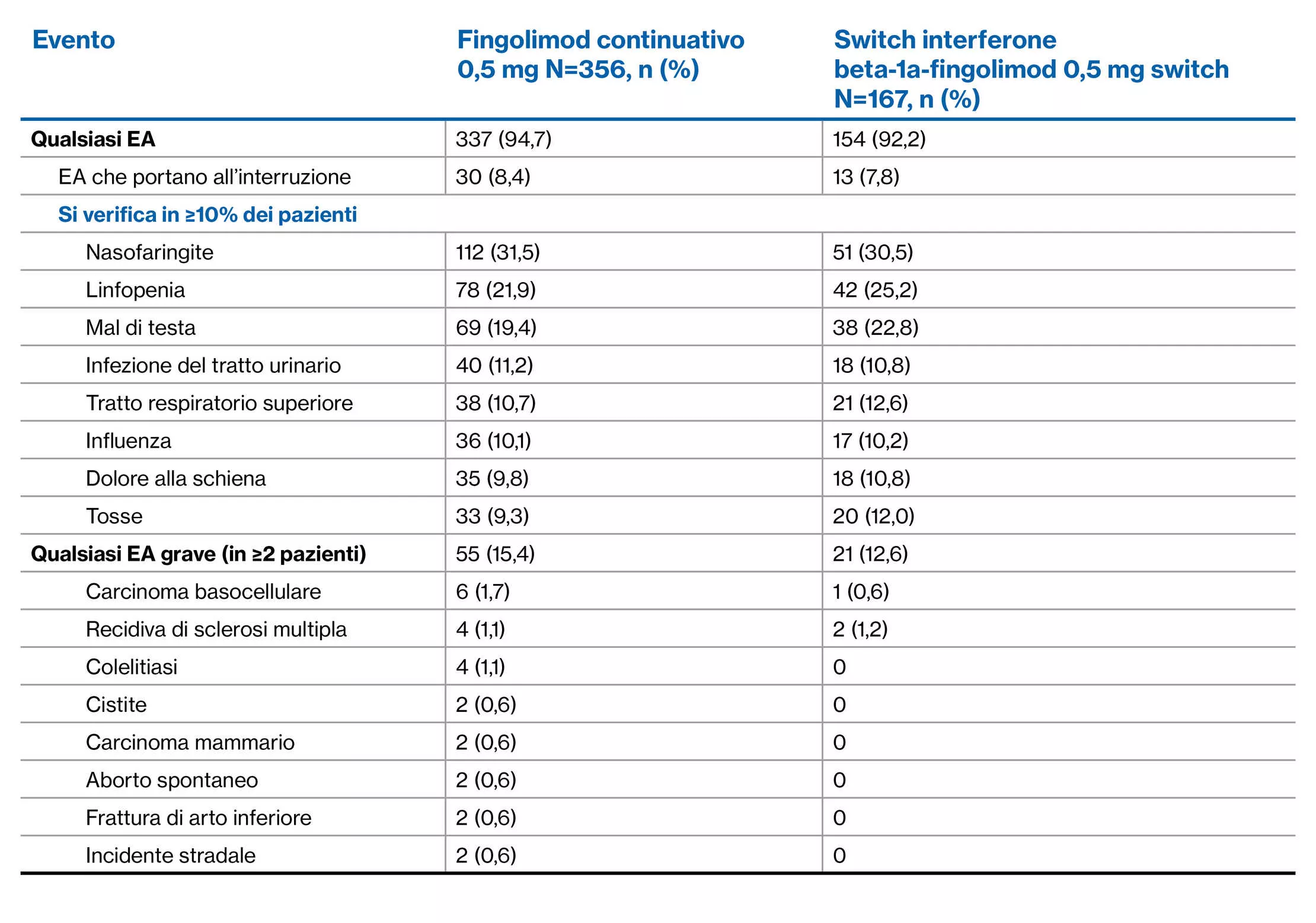
**Tutti i pazienti hanno ricevuto fingolimod 0,5 mg nell’estensione
