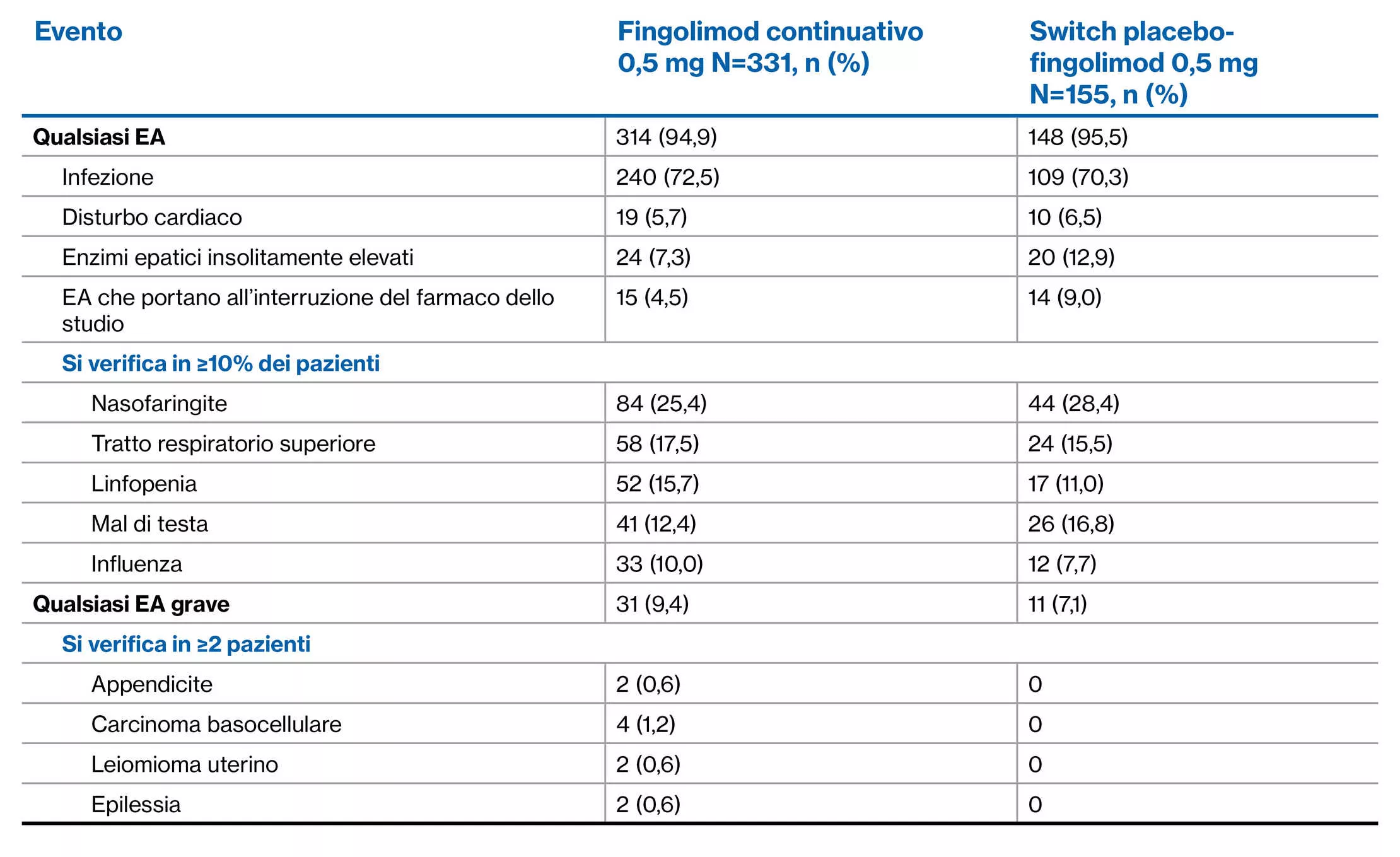
FREEDOMS
Disegno dello studio
Studio di fase 3, in doppio cieco, randomizzato, controllato con placebo, della durata di due anni in adulti affetti da SMRR
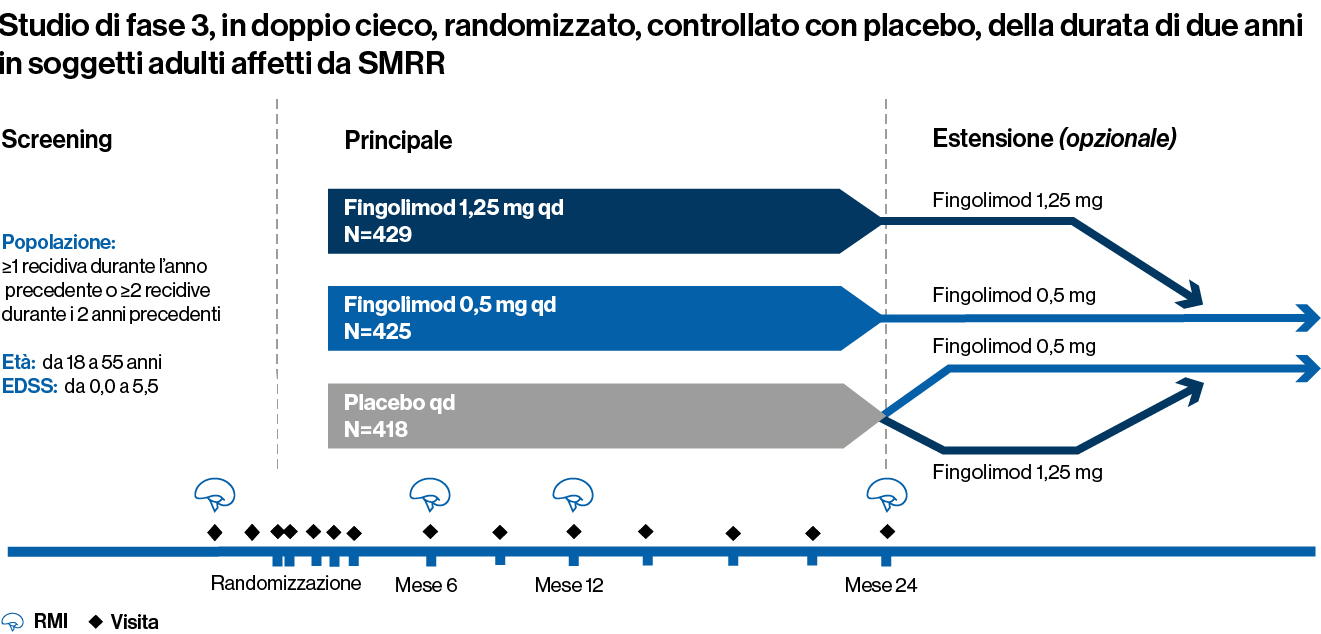
Studio di fase 3, randomizzato, in doppio cieco, controllato con placebo, della durata di 2 anni, condotto su 1.272 adulti affetti da SMRR
I pazienti sono stati assegnati casualmente a ricevere una dose una volta al giorno di fingolimod 0,5 mg (n=425) o 1,25 mg (n=429) o placebo corrispondente una volta al giorno (n=418) per 2 anni
Caratteristiche al basale dei pazienti:
1. Età compresa tra 18 e 55 anni
2. Una diagnosi di SMRR con almeno 1 recidiva documentata durante l’anno precedente o almeno 2 recidive documentate durante i 2 anni precedenti
3. Un punteggio compreso tra 0 e 5,5 sulla scala EDSS. Il punteggio mediano al basale era 2,0
Endpoint primario: ARR
Endpoint secondario principale: tempo alla progressione della disabilità confermata a 3 mesi misurata da almeno un aumento di 1 punto rispetto al basale dell’EDSS (aumento di 0,5 punti per i pazienti con EDSS basale di 5,5) sostenuta per 3 mesi*Ulteriori endpoint secondari includevano il numero di lesioni Gd+ in T1 e il numero di lesioni nuove o di recente aumento di volume alle scansioni di RMI pesata in T2
*L’analisi di un endpoint secondario principale include la stessa popolazione intent-to-treat dell’endpoint primario, nonché la regressione logistica aggiustata per determinate caratteristiche basali del campione
Profilo di EA di fingolimod rispetto al placebo nell’arco di 2 anni: Studi FREEDOMS e FREEDOMS II1
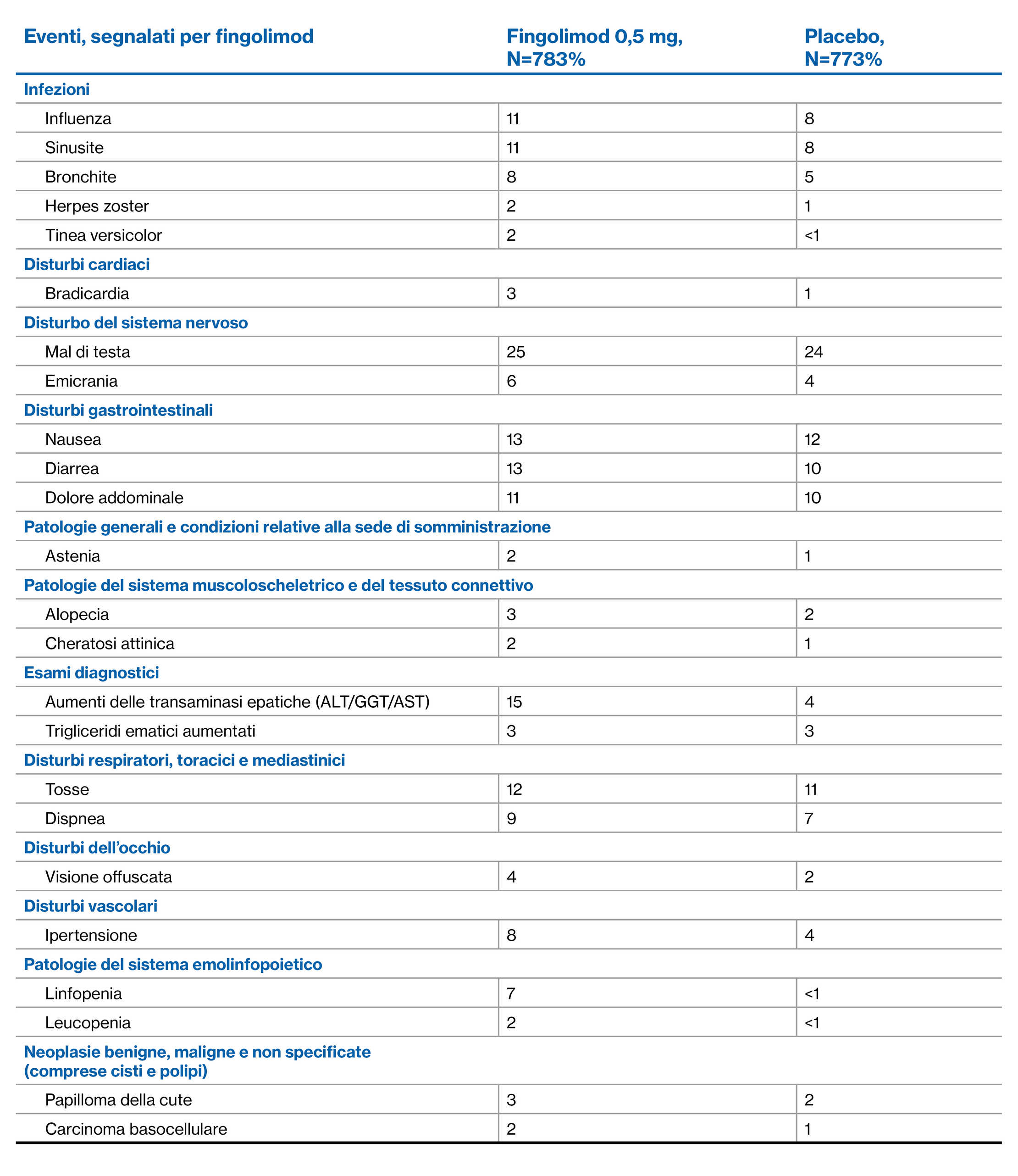
Profilo di EA di fingolimod nell’arco di 4 anni: Studio di estensione FREEDOMS2