TRANSFORMS
Conception de l’étude
Étude de phase 3 d’un an, en double aveugle, randomisée, , à double placebo, avec traitement de référence, chez des adultes atteints de SEP-RR
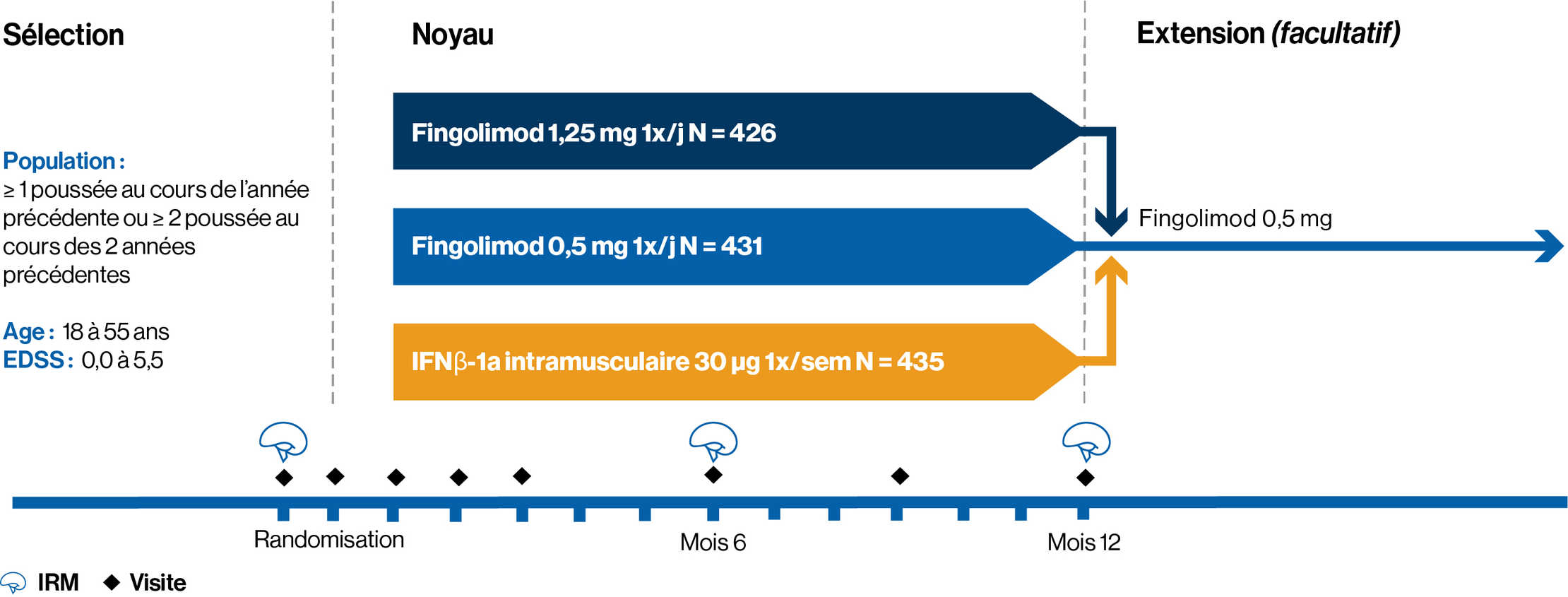
CONCEPTION DE L’ÉTUDE :
Une étude de phase 3 d’un an, randomisée, en double aveugle, à double placebo, contrôlée par traitement actif (IFNβ-1a IM), menée chez 1 292 adultes atteints de SEP-RR
Les patients ont été affectés de manière aléatoire pour recevoir une dose unique quotidienne de fingolimod 0,5 mg (n = 431) ou 1,25 mg (n = 426) ou une injection IM d’IFNβ-1a à une dose hebdomadaire de 30 μg (n = 435) pendant 1 an.
Caractéristiques des patients à l’inclusion :
1. Âgé entre 18 et 55 ans
2. Un diagnostic de SEP-RR avec au moins 1 poussée documentée au cours de l’année précédente ou au moins 2 poussées documentées au cours des 2 années précédentes
3. Un score de 0,0 à 5,5 sur l’échelle EDSS. Le score médian à l’inclusion était de 2,0
4. Un traitement antérieur par tout type d’interféron-bêta ou par acétate de glatiramère n’était pas un critère d’exclusion
Critère d’évaluation principal : l’objectif principal était de démontrer que la dose de fingolimod 0,5 mg était supérieure à la dose d’IFNβ-1a en termes de TAP chez les patients atteints de SEP-RR traités jusqu’à 12 mois
Deux critères d’évaluation secondaires clés : nombre de lésions hyperintenses nouvelles ou nouvellement élargies sur les IRM pondérées en T2 à 1 an et délai jusqu’à la progression confirmée du handicap à 3 mois, mesurée par une augmentation du score EDSS d’au moins 1 point par rapport à l’inclusion (augmentation de 0,5 point pour les patients dont le score EDSS était de 5,5 à l’inclusion) maintenue pendant 3 mois
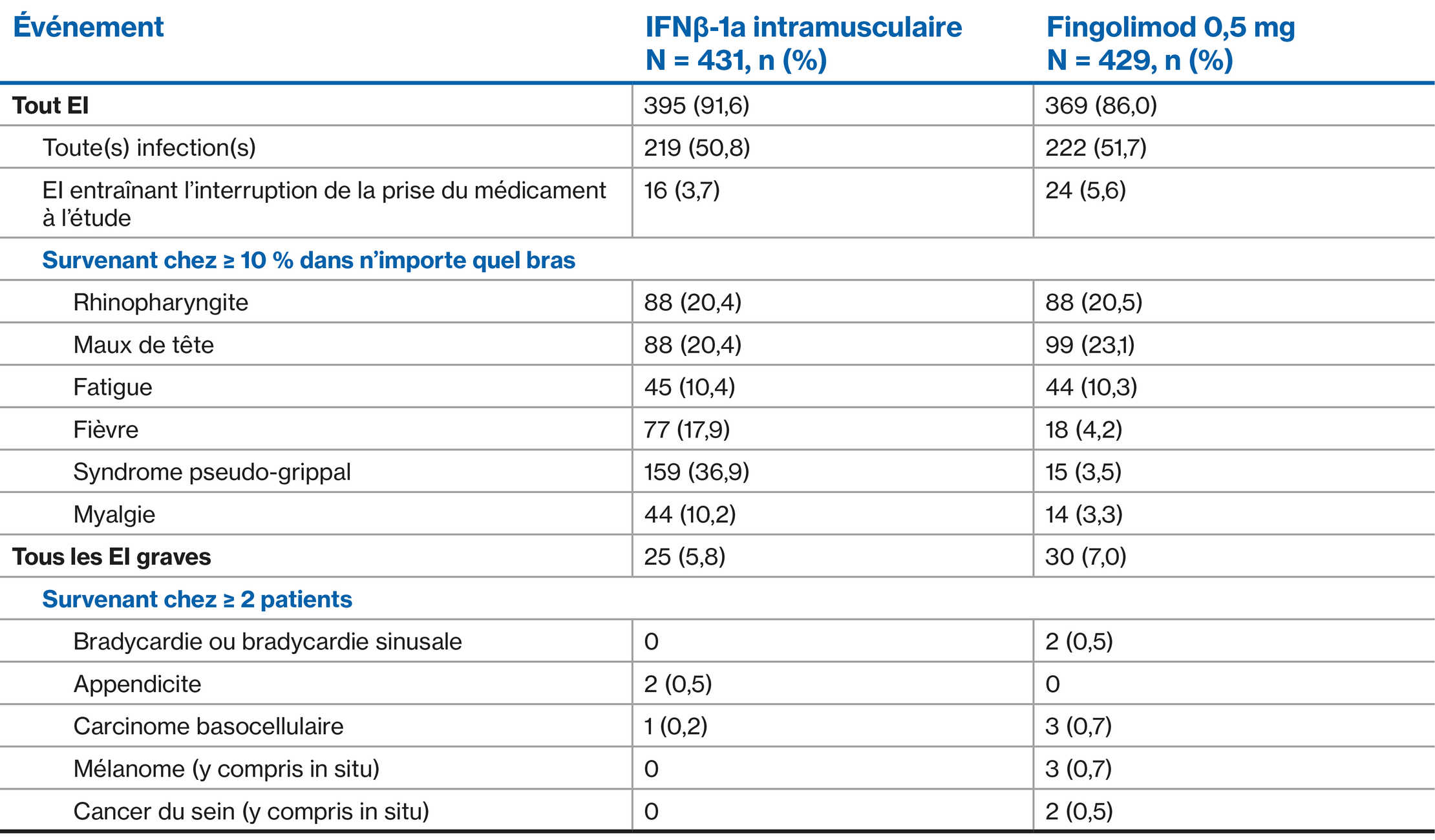
Profil d’EI du fingolimod par rapport à l’interféron sur 1 an : TRANSFORMS Étude principale1
Profil d’EI du fingolimod sur 4 ans et demi : Étude d’extension TRANSFORMS2**
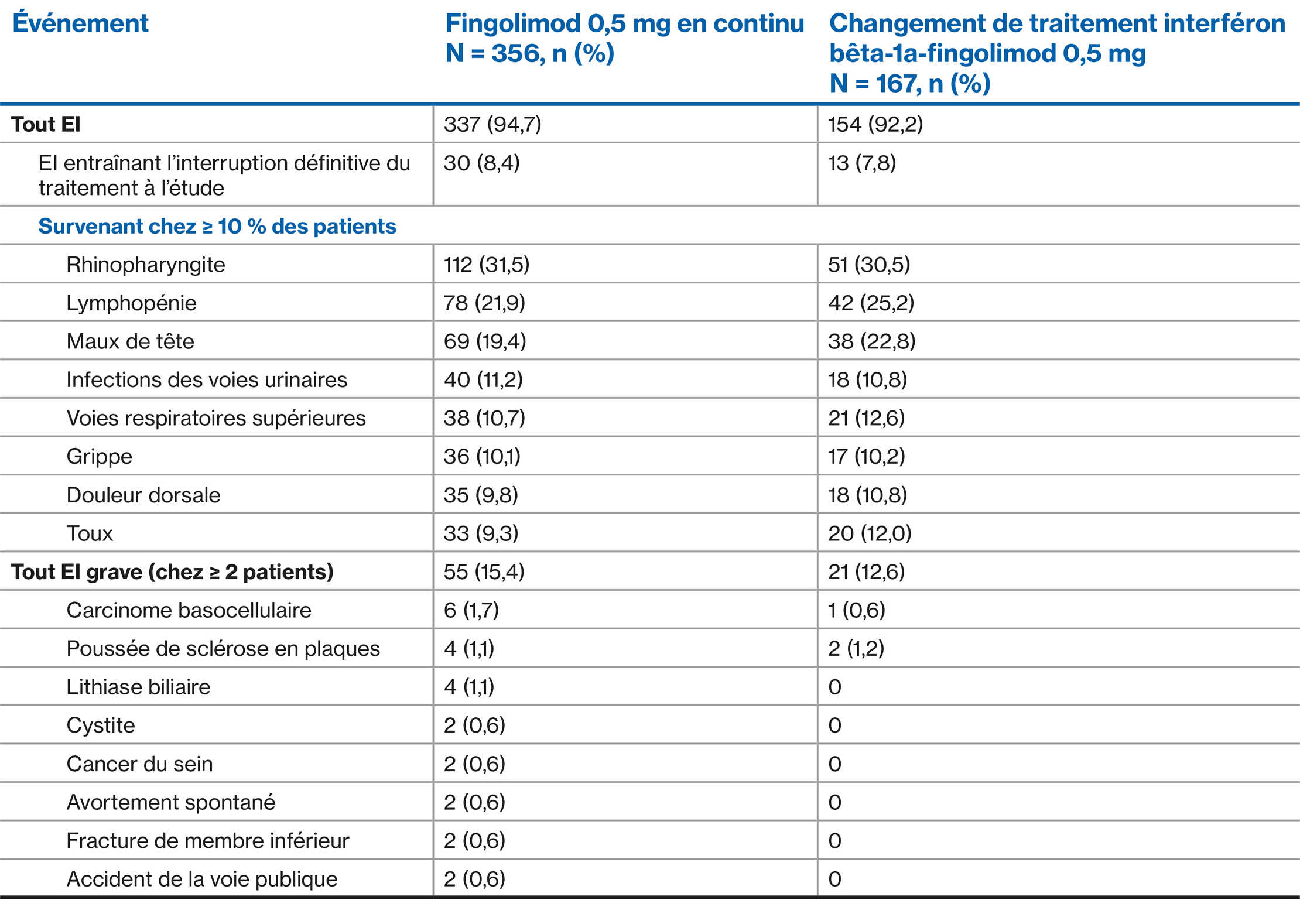
**Tous les patients ont reçu du fingolimod 0,5 mg dans l’extension
