PARADIGMS
Conception de l’étude
Étude de deux ans, en double aveugle, randomisée, avec traitement de référence, par rapport à l’interféron bêta-1a, chez des patients pédiatriques atteints de SEP-RR**
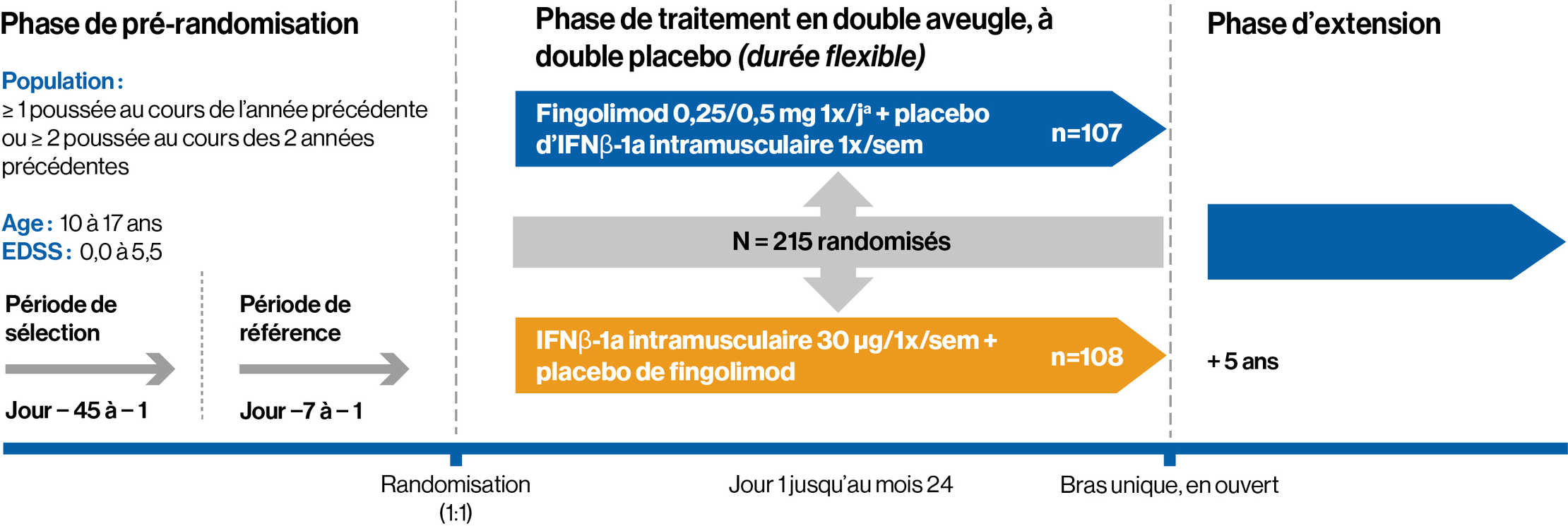
**Le fingolimod n’a pas été étudié chez les enfants âgés de moins de 10 ans
Essai clinique en double aveugle, randomisé, ayant comparé l’efficacité et la sécurité d’emploi du fingolimod 0,25 mg ou 0,5 mg (dose sélectionnée en fonction du poids corporel) une fois par jour à l’interféron bêta-1a 30 mcg par voie intramusculaire (IM) chez 215 patients pédiatriques âgés de 10 à moins de 18 ans atteints de SEP-RR
Caractéristiques des patients à l’inclusion :
1. Diagnostic de SEP-RR basé sur la définition consensuelle révisée pour la SEP pédiatrique, qui comprend les critères de McDonald de 2010
2. Score EDSS : 0-5,5. Le score médian à l’inclusion était de 1,5
3. Patients précédemment traités ou naïfs de traitement, présentant au moins 1 poussée au cours de l’année précédente, ou 2 poussées au cours des 2 années précédentes, ou des preuves d’au moins 1 lésion T1 Gd+
à l’IRM dans les 6 mois précédant la randomisation
4. Aucune preuve de SEP progressive ou d’autres maladies du système immunitaire ou d’autres troubles démyélinisants, d’encéphalomyélite disséminée aiguë
ou de neuromyélite optique
Critère d’évaluation principal : Le taux annualisé de poussée, défini comme le nombre moyen de poussées confirmées par an au cours de la période de traitement actif
Critère d’évaluation secondaire clé : Taux annualisé de lésions nouvelles ou nouvellement élargies détectées à l’IRM pondérée en T2 par rapport à l’inclusion
Autres critères d’évaluation secondaires :
1. Effet sur les lésions T1 Gd+
2. Sécurité d’emploi et tolérance
Les patients devaient rester au centre pendant au moins 6 heures après avoir reçu la première dose du médicament à l’étude (c.-à-d. surveillance de la première dose au jour 1). L’observation de la première dose incluait la surveillance des signes vitaux (fréquence cardiaque et tension artérielle), des signes potentiels de bradycardie et une électrocardiographie
Un traitement antérieur par interféron bêta, fumarate de diméthyle ou acétate de glatiramère était autorisé jusqu’au moment de la randomisation
Des évaluations à l’inclusion et des évaluations neurologiques ont été réalisées lors de la sélection. Des évaluations neurologiques supplémentaires ont été effectuées tous les 3 mois et au moment des suspicions de poussées
Des évaluations par IRM ont été effectuées à la sélection, et tous les 6 mois tout au long de l’étude
**Fingolimod has not been studied in children less than 10 years of age
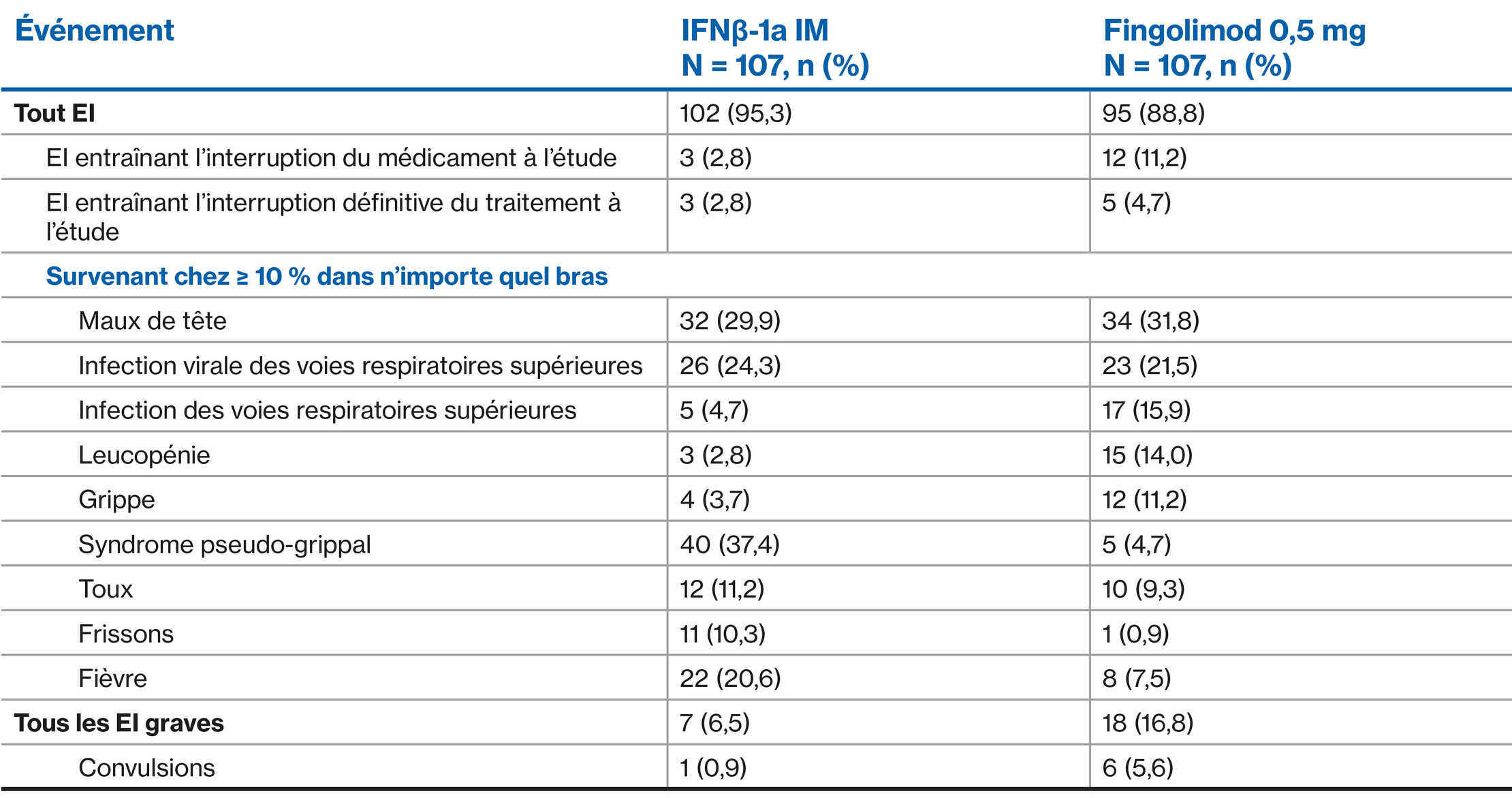
AE profile of fingolimod versus interferon: PARADIGMS double-blind treatment phase1
AE profile of fingolimod over 4.7 years: PARADIGMS extension study (Interim analysis)2
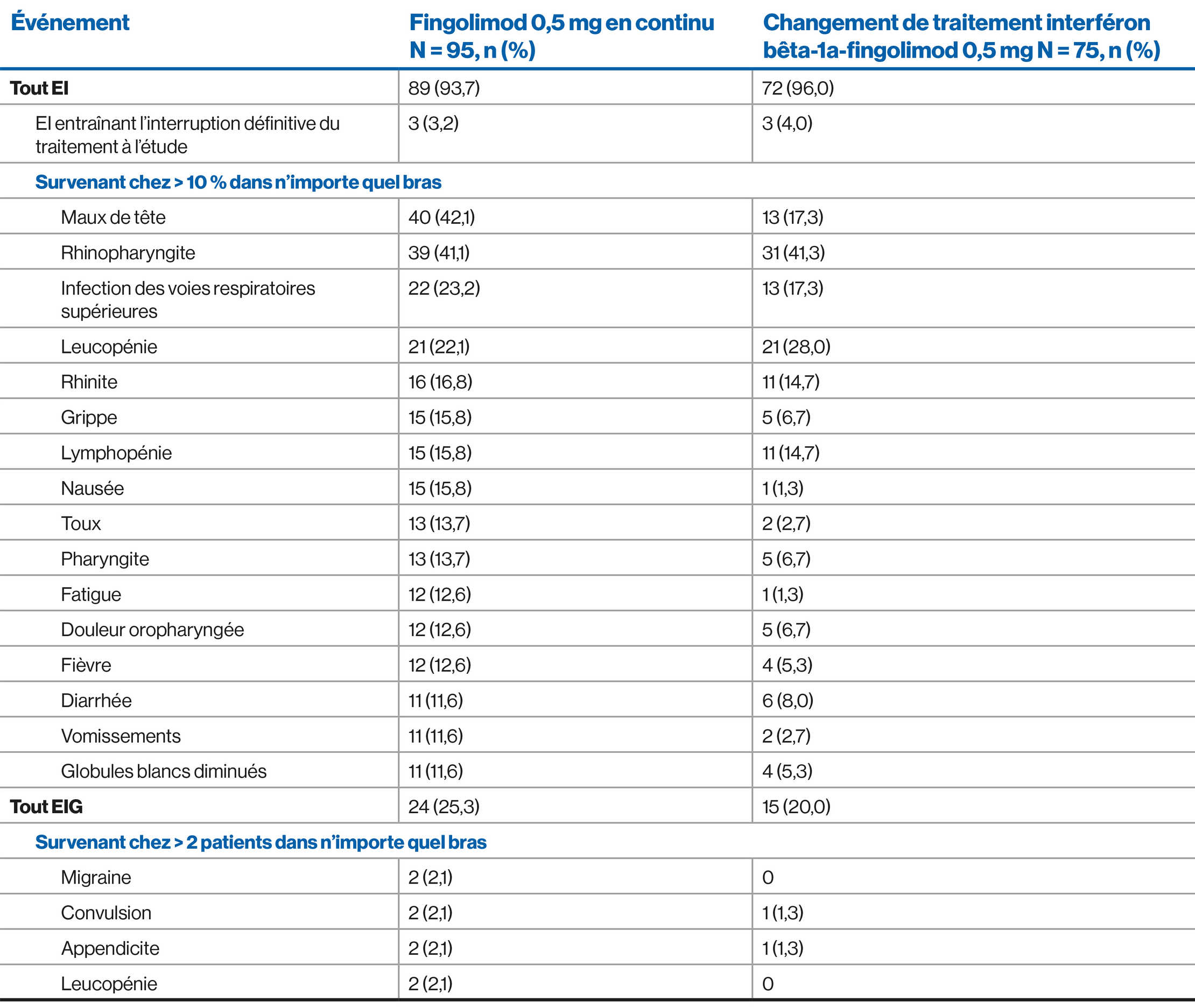
NOTE: Due to the interim nature of the analysis the data shown is subject to changes until the final data base lock.
