COVID-19
Dernière mise à jour : juin 2022. La page sera mise à jour deux fois par an.
It looks like you are using an older version of Internet Explorer which is not supported. We advise that you update your browser to the latest version of Microsoft Edge, or consider using other browsers such as Chrome, Firefox or Safari.
Dernière mise à jour : juin 2022. La page sera mise à jour deux fois par an.
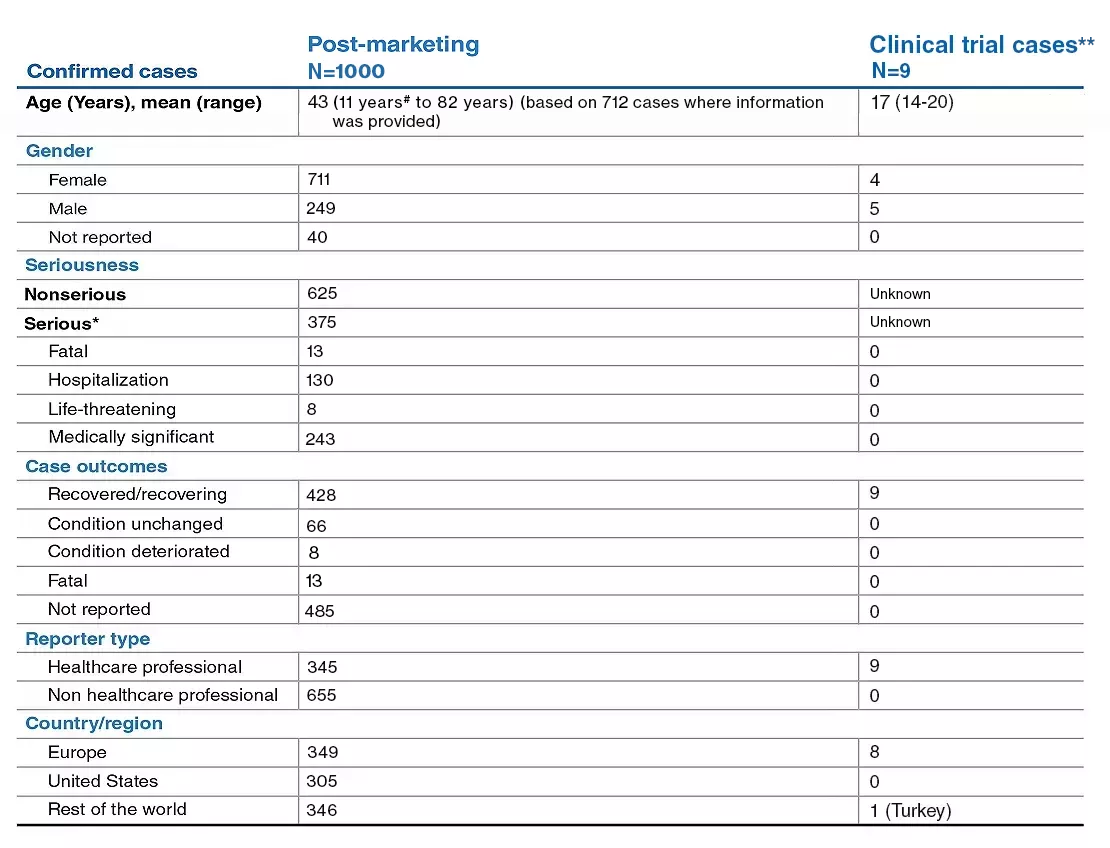
Sur la base de l’ensemble des données disponibles issues des rapports de cas de COVID-19 dans le cadre d’essais cliniques et le contexte post-AMM ainsi qu'une analyse complète des données par l’initiative mondiale de partage des données de la MS Data Alliance.1
Post-AMMa

Dans les 9 cas de l'essai clinique
aCette section fournit un résumé des cas de patients traités par le fingolimod soupçonnés d’avoir ou signalés comme ayant la COVID-19 tels que rapportés dans la base de données d’innocuité de Novartis, y compris les rapports spontanés soumis volontairement et les cas identifiés dans la littérature scientifique. Il y a généralement une sous-déclaration dans ce contexte ; par conséquent, le véritable numérateur est inconnu. Le dénominateur est également inconnu car le nombre réel de patients sous traitement par le fingolimod n’est pas facilement disponible. De nombreux cas contiennent des informations très limitées, et les cas perdus pour le suivi sont inclus. Par conséquent, en raison de ces limitations, il n’est pas possible de tirer des conclusions significatives concernant l’incidence de la COVID-19 ou l’évolution de la maladie chez les patients recevant du fingolimod.
Cas confirmés d’infection à COVID-192,3
Impact de la COVID-19 dans la SEP dans un contexte réel

This website is for non-promotional purposes and is intended for providing
safety information for healthcare professionals (HCP) only
Please confirm that you are an HCP
For HCPs: Information on this website is not country specific, and may contain information that is outside the approved indications in the country in which you are located. Please contact your local Novartis representative for the latest information specific to your country.
For non-HCPs / patients: This safety website is available for HCPs only