PARADIGMS
試験デザイン
小児RRMS患者を対象とした2年間の二重盲検、ランダム化、インターフェロン ベータ-1a対照比較試験**

試験デザイン:
**10歳未満の小児を対象としたフィンゴリモドの試験は行われていない
10~18歳未満の小児RRMS患者215例を対象として、フィンゴリモド0.25 mgまたは0.5 mg(体重に基づいて用量を選択)1日1回を筋肉内投与(IM)インターフェロンベータ-1a 30 mcgと比較した二重盲検無作為化臨床試験
患者のベースライン特性:
1. McDonald 診断基準2010を含め、コンセンサスが得られている小児MSの改定診断基準に基づき、RRMSと診断
2. EDSSスコア:0~5.5。 ベースライン時のスコア中央値は1.5
3. 無作為化前の過去1年間に少なくとも1回の再発、または過去2年間に2回の再発、または過去6ヵ月間に少なくとも1個のGd造影病変を有する患者(治療歴有、無しいずれも含まれる)
4. 進行型MS、視神経脊髄炎、急性散在性脳脊髄炎、その他の免疫系疾患・脱髄性疾患のエビデンスがない
主要評価項目:年間再発率(コアパートにおける年間平均再発数と定義)
主な副次的評価項目:1年あたりの新規または新たに拡大したT2病変数のベースラインからの変化
その他の副次的評価項目:
1. Gd造影T1病変に対する有効性
2. 安全性および忍容性
患者は、治験薬の初回投与後少なくとも6時間(すなわち、Day 1の初回投与モニタリング)は治験実施施設に滞在することを必要とした。初回投与の観察には、バイタルサイン(心拍数および血圧)のモニタリング、徐脈の潜在的徴候、心電図検査が含まれる
無作為化時までのインターフェロン・ベータ、フマル酸ジメチル、またはグラチラマー酢酸塩による前治療は許容された
ベースライン評価および神経学的評価はスクリーニング時に実施。追加の神経学的評価を3ヵ月ごとおよび再発疑い時に実施したMRI評価はスクリーニング時および治験期間を通して6ヵ月ごとに実施した
**10歳未満の小児を対象としたフィンゴリモドの試験は行われていない
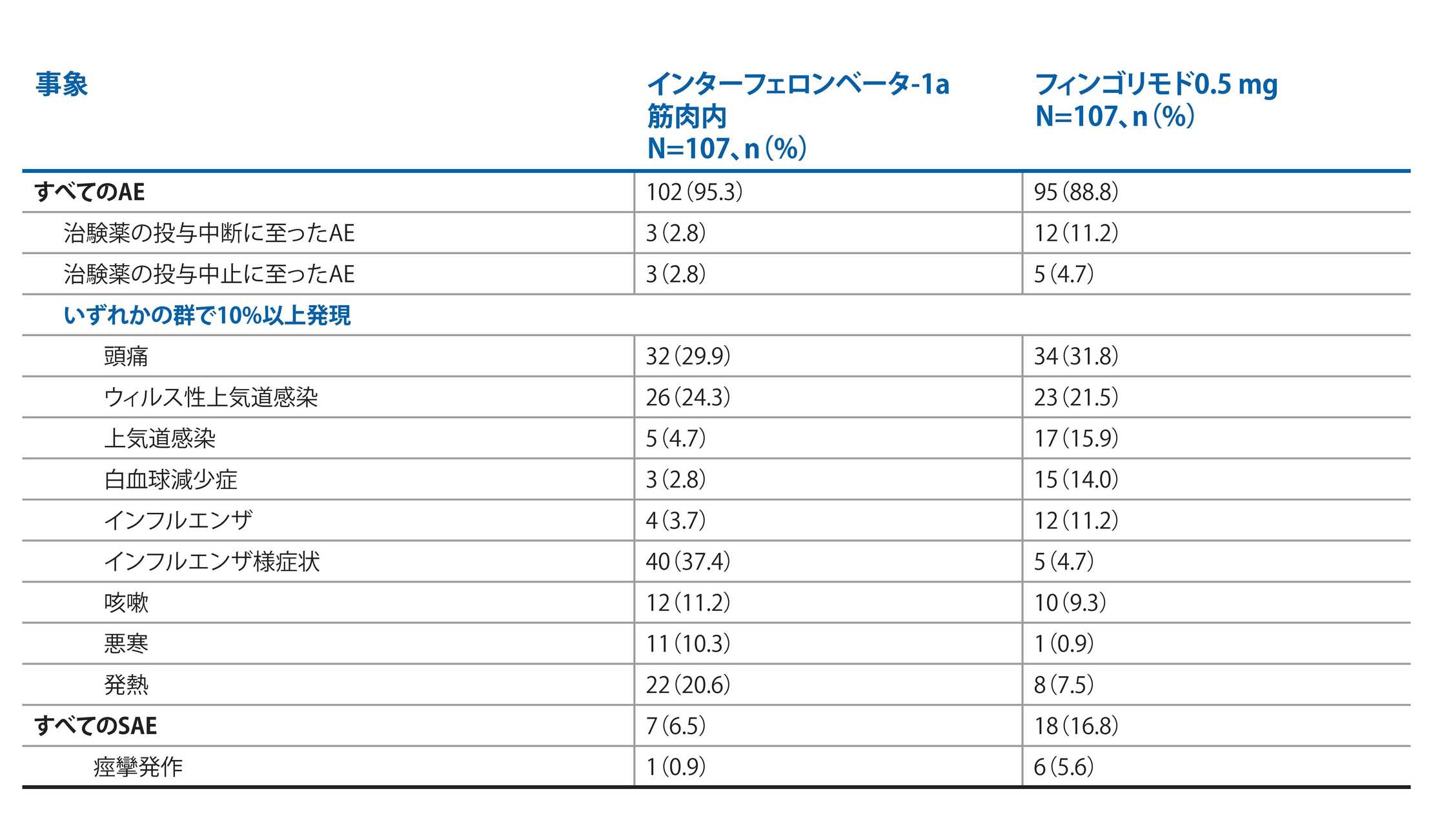
フィンゴリモドとIFNβ-1aのAEプロファイル:PARADIGMS二重盲検治療期1
4.7年間のフィンゴリモドのAEプロファイル:PARADIGMS延長試験(中間解析)2
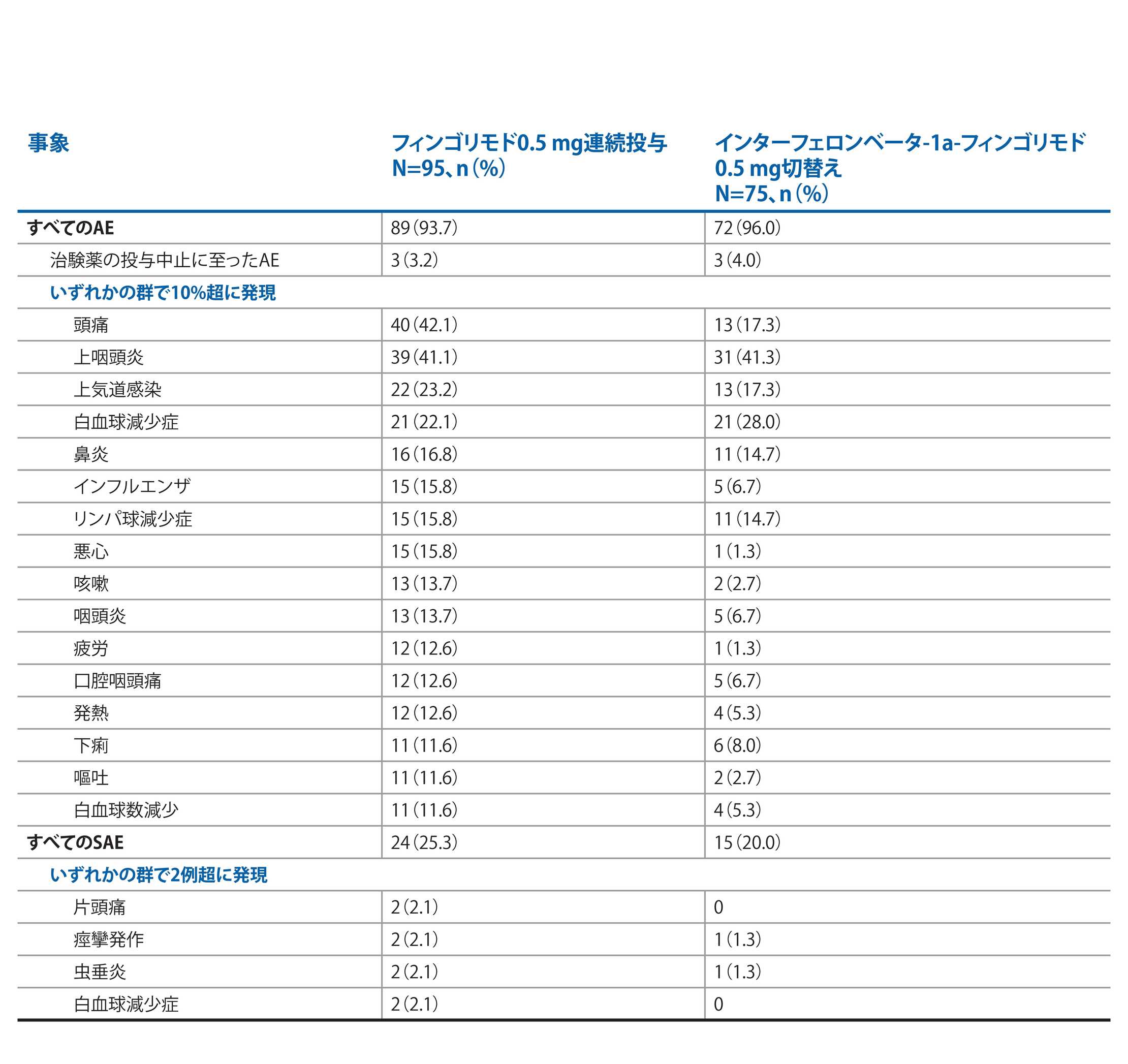
注:中間解析であるため、最終的なデータベースロックまでにデータは変更される可能性がある。
