COVID-19
最終更新日:2021年7月。ページは年に2回更新されます
It looks like you are using an older version of Internet Explorer which is not supported. We advise that you update your browser to the latest version of Microsoft Edge, or consider using other browsers such as Chrome, Firefox or Safari.
最終更新日:2021年7月。ページは年に2回更新されます
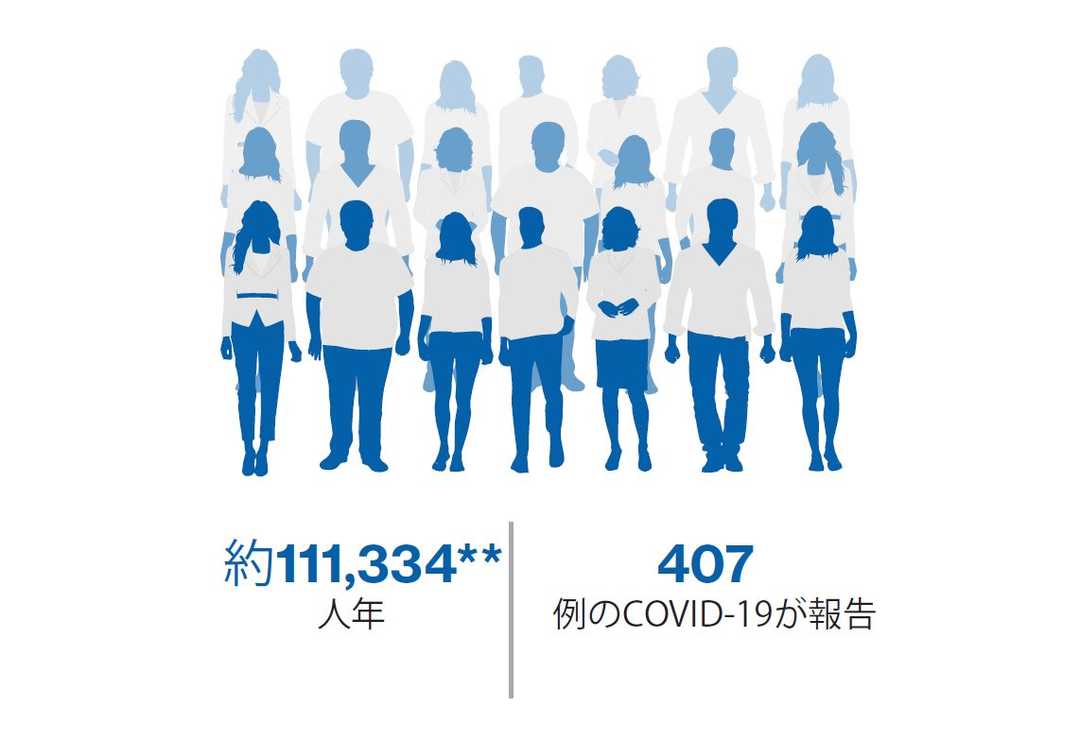
市販後のCOVID-19の症例報告と「MS Data Alliance, Global Data Sharing Initiative」による包括的なデータ解析に基づきます1
市販後
In the 9 clinical trial cases
aThis section provides a summary of cases of fingolimod-treated patients either suspected as having or reported to have COVID-19 as reported in the Novartis safety database, including spontaneous reports submitted voluntarily and cases identified in the scientific literature. There is typically underreporting in this setting; therefore, the true numerator is unknown. The denominator is also unknown as the actual number of patients on therapy with fingolimod is not readily available. Many of the cases contain very limited information, and cases lost to follow up are included. Therefore, due to these limitations, it is not possible to draw any meaningful conclusions concerning the incidence of COVID-19 or course of illness in patients receiving fingolimod.
COVID-19感染が確認された症例2
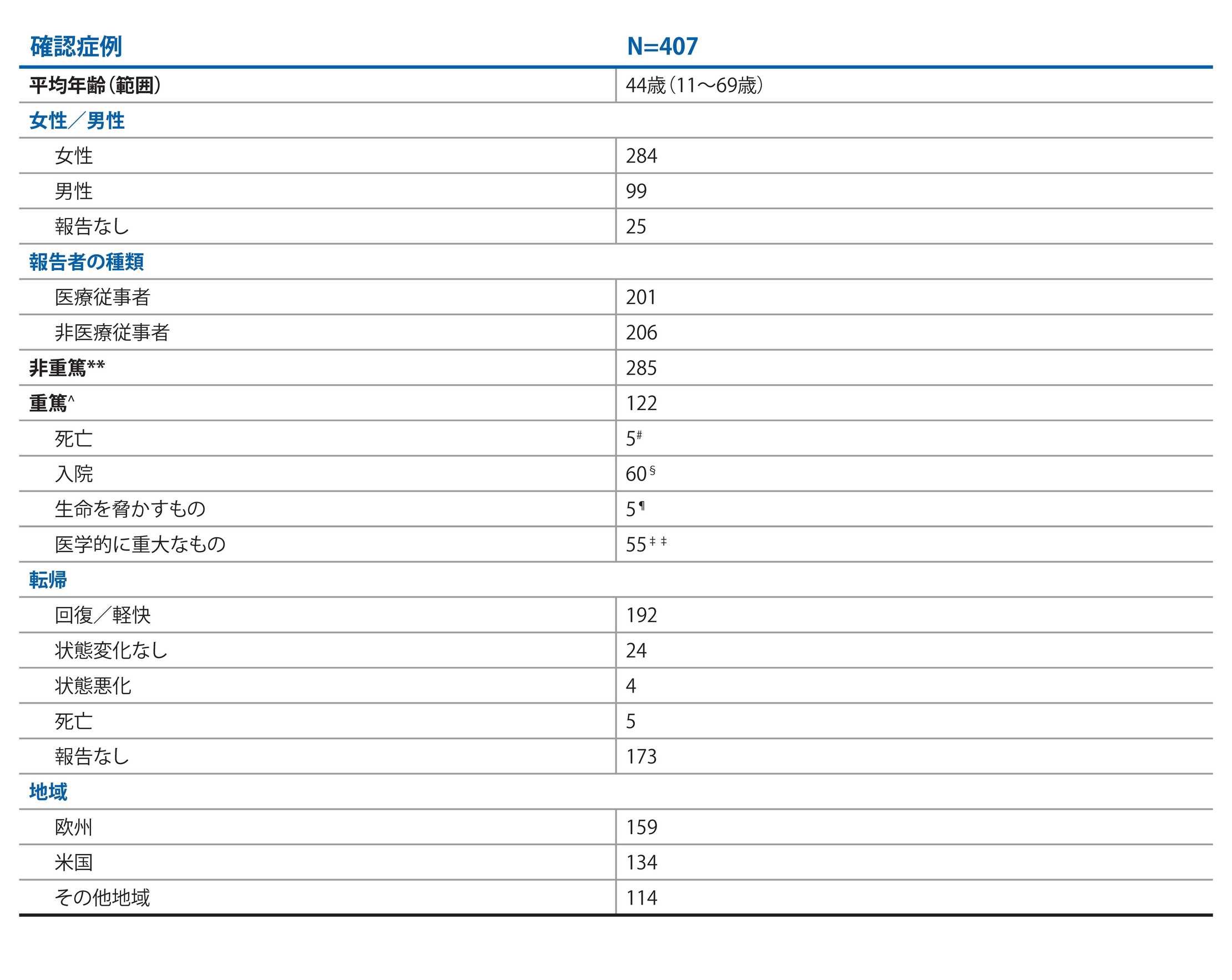
COVID-19の重症度および転帰2
MSに対するCOVID-19の影響

This website is for non-promotional purposes and is intended for providing
safety information for healthcare professionals (HCP) only
Please confirm that you are an HCP
For HCPs: Information on this website is not country specific, and may contain information that is outside the approved indications in the country in which you are located. Please contact your local Novartis representative for the latest information specific to your country.
For non-HCPs / patients: This safety website is available for HCPs only