PARADIGMS
Studiendesign
Doppelblinde, randomisierte, aktiv-kontrollierte Zweijahresstudie im Vergleich zu Interferon beta-1a bei pädiatrischen Patienten mit RRMS**
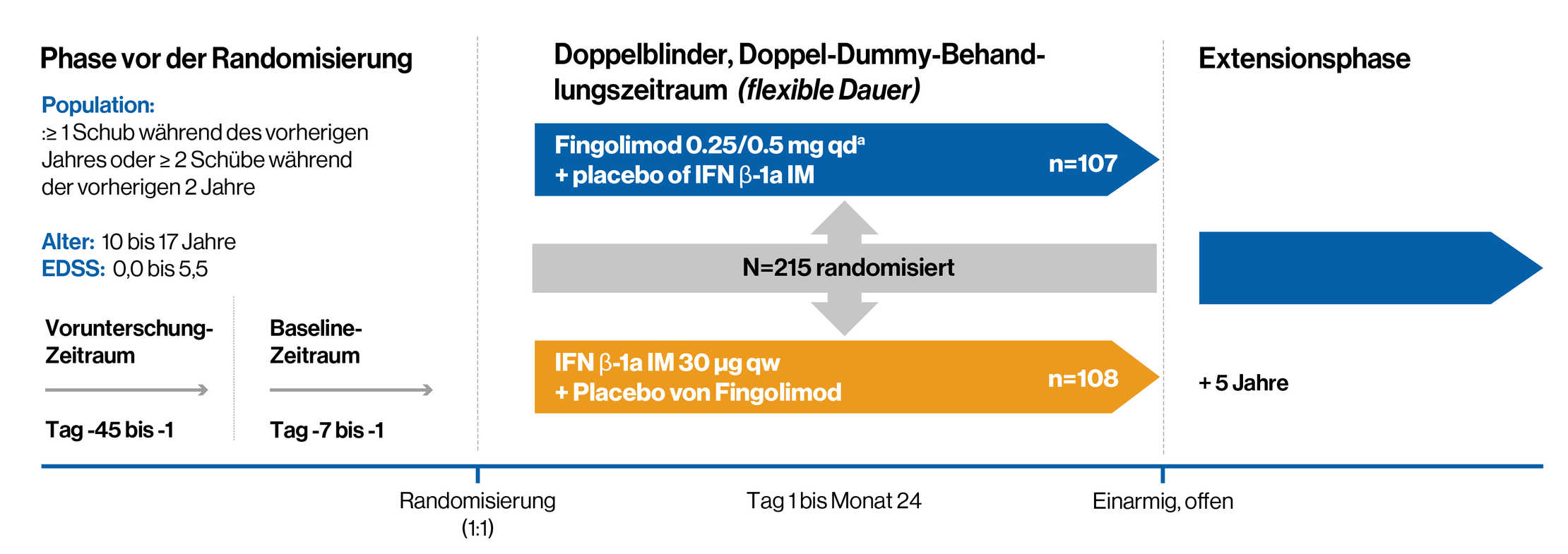
**Fingolimod ist bei Kindern unter 10 Jahren nicht untersucht worden.
Eine doppelblinde, randomisierte klinische Studie, in der die Wirksamkeit und Sicherheit von Fingolimod 0,25 mg oder 0,5 mg (Dosis auf der Grundlage des Körpergewichts) einmal täglich mit intramuskulärem (IM) Interferon beta-1a 30 mcg bei 215 pädiatrischen Patienten im Alter von 10 bis unter 18 Jahren mit RRMS verglichen wurde.
Grundlegende Merkmale der Patienten:
1. RRMS-Diagnose auf der Grundlage der überarbeiteten Konsensdefinition für pädiatrische MS, die die McDonald-Kriterien von 2010 enthält.
2. EDSS Score: 0-5.5. Der mediane Score bei Baseline betrug 1,5.
3. Zuvor behandelte oder therapienaive Patienten mit mindestens einem Rückfall im letzten Jahr oder 2 Rückfällen in den letzten 2 Jahren oder Nachweis von mindestens einem Gd+
T1-Läsion im MRT in den 6 Monaten vor der Randomisierung
4. Keine Hinweise auf progressive MS oder andere Erkrankungen des Immunsystems oder andere demyelinisierende Störungen, akute disseminierte Enzephalomyelitis, oder Neuromyelitis optica
Primärer Endpunkt: Die jährliche Rückfallquote, definiert als die durchschnittliche Anzahl der bestätigten Rückfälle pro Jahr während des aktiven Behandlungszeitraums
Wichtigster sekundärer Endpunkt: Die auf das Jahr hochgerechnete Rate neuer oder neu vergrößerter Läsionen, die im T2-gewichteten MRT im Vergleich zum Wert bei Baseline entdeckt wurden.
Andere sekundäre Endpunkte:
1. Wirkung auf Gd+ T1 Läsionen
2. Sicherheit und Verträglichkeit
Die Patienten mussten mindestens 6 Stunden nach Erhalt der ersten Dosis des Prüfpräparats im Prüfzentrum bleiben (h. h. Überwachung der ersten Dosis an Tag 1). Die Beobachtung der ersten Dosis umfasste die Überwachung der Vitalparameter (Herzfrequenz und Blutdruck), um mögliche Anzeichen einer Bradykardie zu erkennen, sowie eine Elektrokardiographie.
Eine vorherige Therapie mit Interferon-beta, Dimethylfumarat oder Glatirameracetat bis zum Zeitpunkt der Randomisierung war zulässig.
Beim Screening wurden die Werte bei Baseline und die neurologischen Untersuchungen durchgeführt. Zusätzliche neurologische Untersuchungen wurden alle 3 Monate und bei Verdacht auf einen Schub durchgeführt.MRT-Untersuchungen wurden beim Screening und alle 6 Monate während der Studie durchgeführt.
**Fingolimod ist bei Kindern unter 10 Jahren nicht untersucht worden.
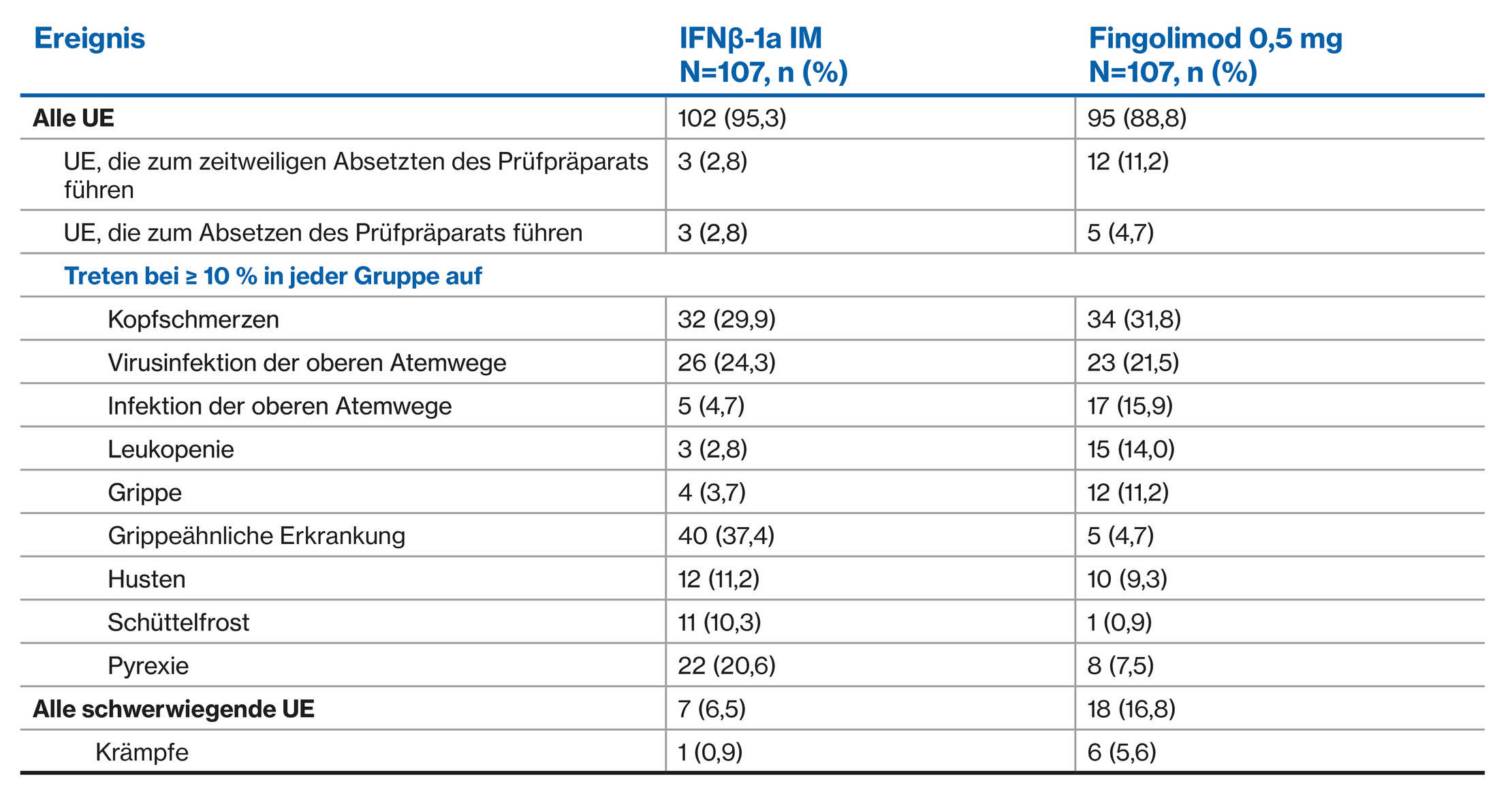
UE-Profil von Fingolimod versus Interferon: PARADIGMS doppelblinde Behandlungsphase1
UE-Profil von Fingolimod über 4,7 Jahre: PARADIGMS-Extensionsstudie (Zwischenanalyse)2
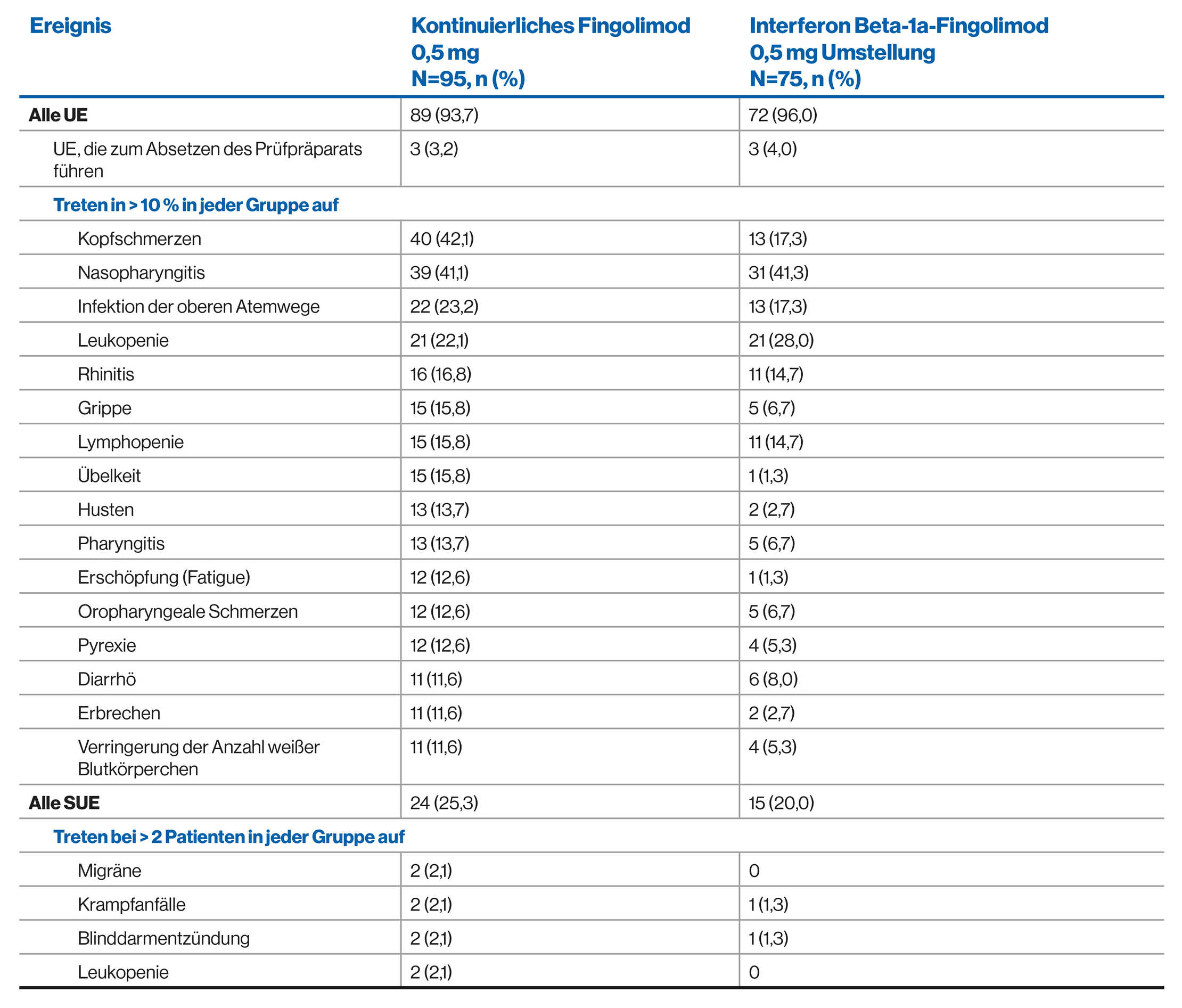
HINWEIS: Aufgrund des vorläufigen Charakters der Analyse können die angegebenen Daten bis zur endgültigen Sperrung der Datenbank noch Änderungen unterliegen.
