FREEDOMS
Studiendesign
Doppelblinde, randomisierte, placebokontrollierte zweijährige Phase-3-Studie bei Erwachsenen mit RRMS
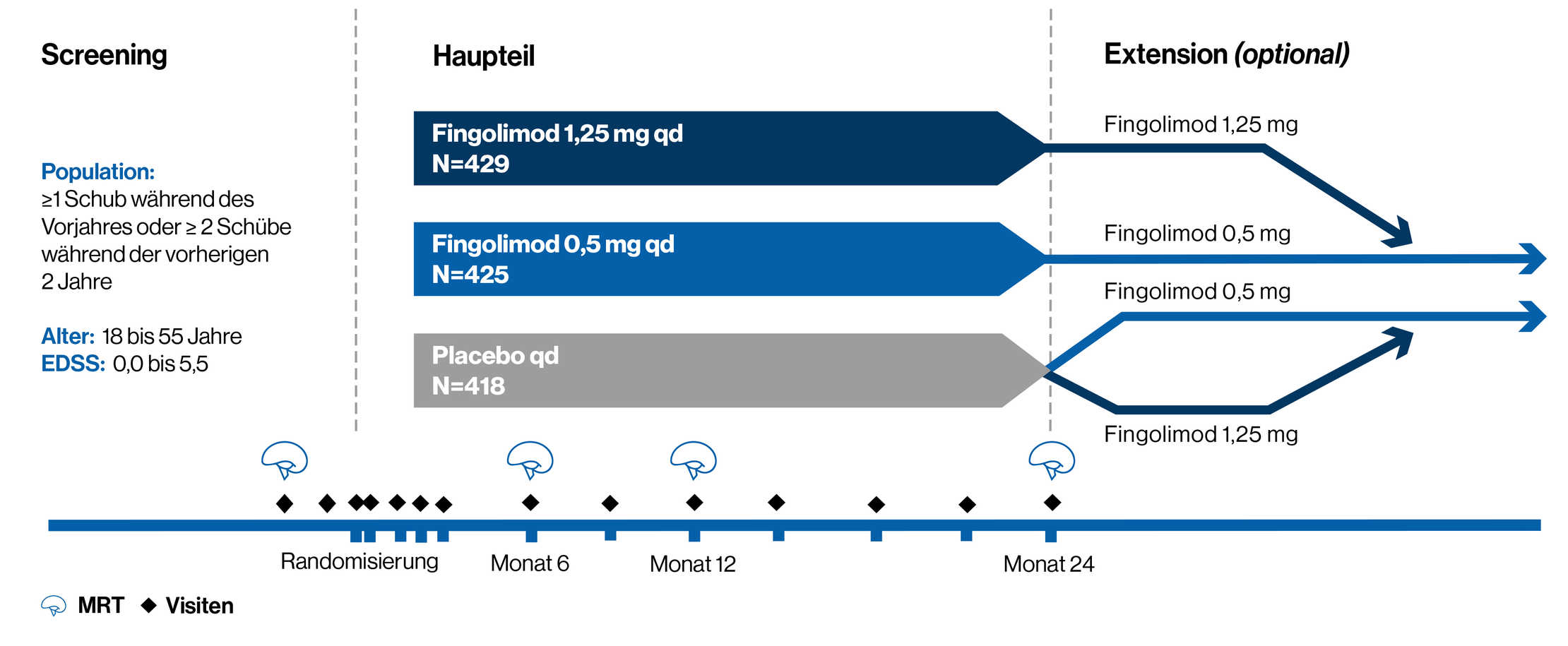
Eine 2-jährige, randomisierte, doppelblinde, placebokontrollierte Phase-3-Studie mit 1.272 Erwachsenen mit RRMS
Die Patienten erhielten nach dem Zufallsprinzip eine eine tägliche Einmaldosis von Fingolimod 0,5 mg (n = 425) oder 1,25 mg (n = 429) oder ein entsprechendes Placebo einmal täglich (n = 418) über einen Zeitraum von 2 Jahren.
Grundlegende Merkmale der Patienten:
1. Zwischen 18 und 55 Jahre alt
2. Eine Diagnose von RRMS mit mindestens einem dokumentierten Rückfall während des letzten Jahres oder mindestens zwei dokumentierten Rückfällen während der letzten zwei Jahre.
3. Ein Score von 0,0 bis 5,5 auf dem EDSS. Der Medianwert bei Baseline betrug 2,0.
Primärer Endpunkt: ARR
Wichtigster sekundärer Endpunkt: Zeit bis zum bestätigten Fortschreiten der Behinderung nach drei Monaten, gemessen an einem Anstieg des EDSS um mindestens 1 Punkt gegenüber dem Ausgangswert (0,5 Punkte bei Patienten mit einem Ausgangswert von 5,5), der über drei Monate anhält**Weitere sekundäre Endpunkte waren die Anzahl der Gd+ T1-Läsionen und die Anzahl der neuen oder neu vergrößerten Läsionen auf T2-gewichteten MRT-Scans.
**Die Analyse eines wichtigen sekundären Endpunkts umfasst dieselbe Intent-to-Treat-Population wie der/die primäre(n) Endpunkt(e) sowie eine logistische Regression, die für bestimmte Ausgangsmerkmale der Stichprobe angepasst wird.
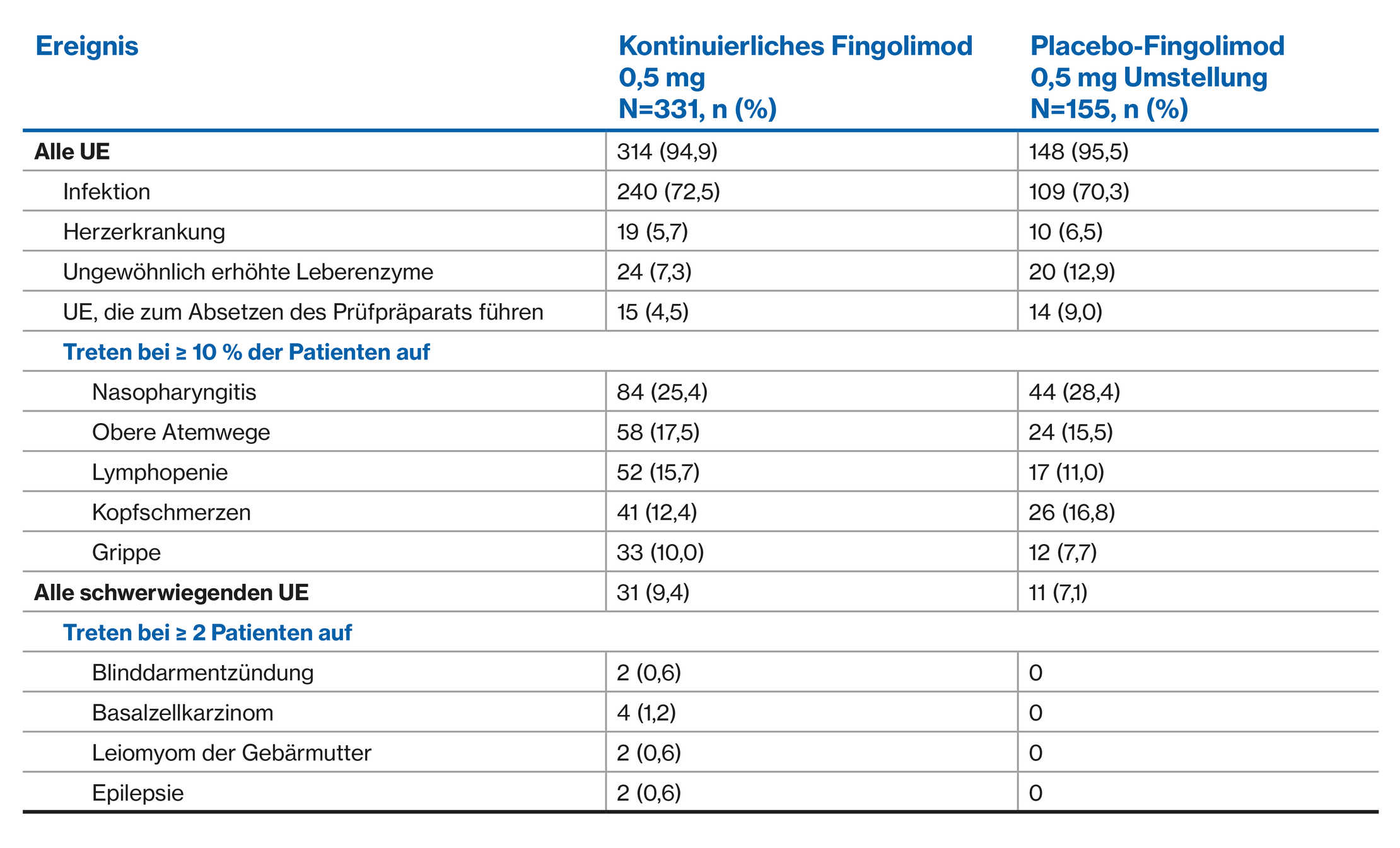
UE-Profil von Fingolimod versus Placebo über 2 Jahre: FREEDOMS und FREEDOMS II Studien1
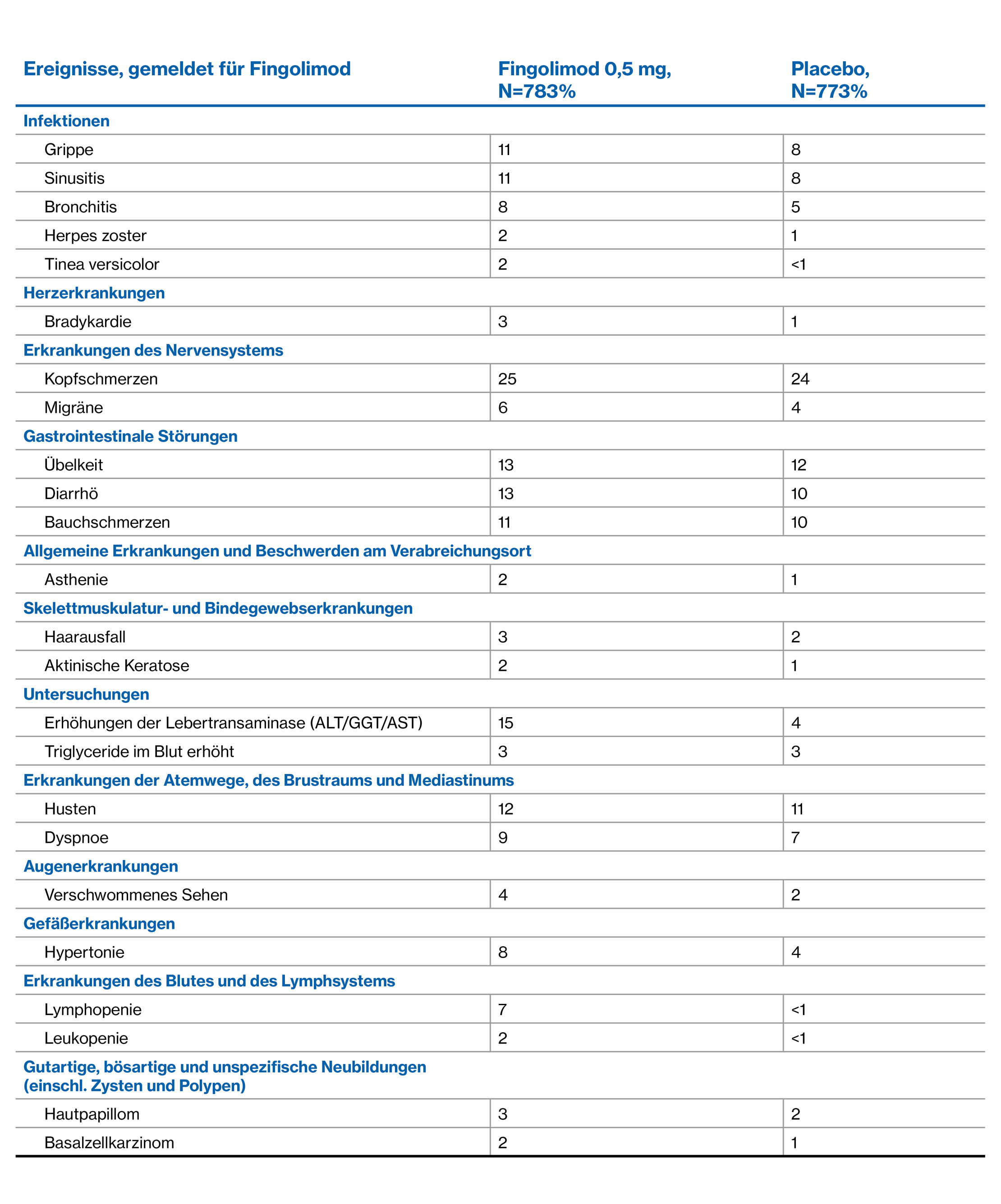
UE-Profil von Fingolimod über 4 Jahre: Studie zur Verlängerung von Freedom
Extensionsstudie2